|
I°) Les solutions acides :
a) Rappel sur le pH :
Tous les liquides sont caractérisés par un nombre appelé
pH compris entre 1 et 14. Plus le pH est faible plus la solution est acide.
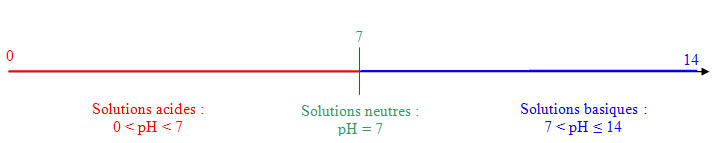
Mesure de pH :
- Avec du papier pH.
- Avec un pHmètre.
b) Les solutions acides :
Définition : L'acidité d'une solution
est liée à la présence d'ion hydrogène, plus
il y a d'ions H+ plus la solution est acide.
Exemples :
Solution d'acide chlorhydrique : (H+ + Cl-)
Solution d'acide sulfurique : (H+ + SO4-)
Solution d'acide nitrique : (H+ + NO3-)
c) Danger des solutions acides :
Ces solutions sont corrosives.
Pour les manipuler il faut donc se munir de gants et souvent, de lunettes
de protection.
II°) Attaque des métaux
par une solution d'acide chlorhydrique :
a) Réaction de l'aluminium
avec l'acide chlorhydrique :
|
Expérience
|
Observations
|
Conclusion
|
| On place de la poudre d'aluminium au fond d'un tube
à essais puis on verse environ 3 mL d'acide chlorhydrique. |
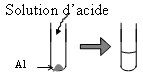
On observe une effervescence au niveau
de l'aluminium.
|
Il y a réaction chimique
entre l'aluminium et l'acide chlorhydrique. |
| Pendant la réaction boucher pendant 2 minutes
le tube à essais puis ouvrir et approcher une allumette enflammée. |
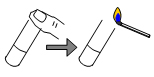
On entend une petite détonation.
|
Le gaz qui se dégage
est du dihydrogène. |
| A la fin de la réaction : on observe l'aluminium
|
Il y a de moins en moins d'aluminium.
|
L'aluminium disparaît. |
| Mesurer le pH de la solution. |
Le pH vaut maintenant 4, il
a augmenté. |
Il y a moins d'ions hydrogène
qu'au départ. |
| Verser la moitié du liquide dans
un 2ème tube et ajouter quelques gouttes de nitrate d'argent
|
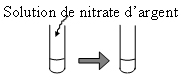
On observe un précipité
blanc.
|
Il y a des ions
chlorures. |
Dans le premier tube on ajoute quelques
gouttes de soude.
|
On observe un précipité
blanc.
|
Il y a des ions
aluminium. |
b) Conclusion :
L'aluminium réagit avec
les ions hydrogène de l'acide chlorhydrique pour former des ions
aluminium et du dihydrogène.
c) Généralisation aux autres métaux
:
Expérience n°1 :

Conclusion n°1 :
- Avec le cuivre, il ne se passe rien: l'acide chlorhydrique
ne réagit pas avec le cuivre.
- Avec les autres métaux, il y a effervescence qui traduit un dégagement
gazeux. L'acide chlorhydrique réagit avec le zinc, le fer et l'aluminium.
- L'approche d'une allumette enflammée provoque une détonation
sauf avec le tube contenant le cuivre et l'acide chlorhydrique. La détonation
montre qu'il s'est formé un gaz : le dihydrogène.
|
Expérience n°2 :

|
Observation n°2 :
- Dans le tube 1, il se forme un précipité vert.
- Dans le tube 2, il se forme un précipité blanc.
|
|
Expérience n°2 :

|
Observation n°3 :
Dans les deux tubes il se forme un précipité blanc.
|
Conclusion :
- Le test à la soude détermine la présence
d'ions métalliques :
- Les ions fer II dans le tube 1 car le précipité
formé est l'hydroxyde de fer II.
- Les ions zinc dans le tube 2 car le précipité
formé est l'hydroxyde de zinc.
- Le test au nitrate d'argent détermine la présence
d'ions chlorure dans les deux tubes car le précipité
formé est le chlorure d'argent.
d) Equations-bilans des réactions
:
1) Avec le fer :
- réactifs : fer et acide chlorhydrique
- produits : dihydrogène (allumette), ions chlorure (test au nitrate
d'argent) et ions fer II (test à la soude).
|
acide chlorhydrique
|
+
|
fer
|
|
chlorure de fer II
|
+
|
dihydrogène
|
|
2 (H+ + Cl-)
|
+
|
Fe
|
|
(Fe2+ + 2 Cl-)
|
+
|
H2
|
| Les ions Cl - ne réagissent pas. Il y a conservation
des ions chlorure. On peut alors écrire : |
|
2 H+
|
+
|
Fe
|
|
Fe2+
|
+
|
H2
|
2) Avec le zinc :
- réactifs : zinc et acide chlorhydrique
- produits : dihydrogène (allumette), ions chlorure (test au nitrate
d'argent) et ions zinc (test à la soude).
|
acide chlorhydrique
|
+
|
zinc
|
|
chlorure de fer II
|
+
|
dihydrogène
|
|
2 (H+ + Cl-)
|
+
|
Zn
|
|
(Zn2+ + 2 Cl-)
|
+
|
H2
|
| Les ions Cl - ne réagissent pas. Il y a conservation
des ions chlorure. On peut alors écrire : |
|
2 H+
|
+
|
Zn
|
|
Zn2+
|
+
|
H2
|
3) Avec l'aluminium :
- réactifs : aluminium et acide chlorhydrique
- produits : dihydrogène (allumette), ions chlorure (test au nitrate
d'argent) et ions aluminium (test à la soude).
|
acide chlorhydrique
|
+
|
aluminium
|
|
chlorure d'aluminium
|
+
|
dihydrogène
|
|
6 (H+ + Cl-)
|
+
|
2 Al
|
|
2 (Al3+ + 2 Cl-)
|
+
|
H2
|
| Les ions Cl - ne réagissent pas. Il y a conservation
des ions chlorure. On peut alors écrire : |
|
6 H+
|
+
|
2 Al
|
|
2 Al3+
|
+
|
3 H2
|
|