|
Gaz
|
Vénus
|
Mars
|
Terre
|
Terre sans vie
|
|
Dioxyde de carbone (CO2)
|
96
|
95
|
0,034
|
99,8
|
|
Diazote (N2)
|
3,5
|
2,7
|
78,1
|
0,009
|
|
Dioxygène (O2)
|
0,003
|
0,15
|
20,9
|
0,09
|
|
Argon (Ar)
|
0,006
|
1,6
|
0,93
|
-
|
D’après « La Terre et l’Univers », Hachette Éducation et « Sciences illustrées » (N°6 juin 1993)
a) L'air est-il un corps pur ? pourquoi ?
Les principaux constituants de l’air sont :
- le dioxygène de formule O2 et dont le pourcentage est d’environ 20%.
- le diazote de formule N2 et dont le pourcentage est d’environ 80%.
Le dioxygène est composé de molécules qui résultent de l’association de deux atomes d’oxygène d’où le nom de dioxygène.
L’atome d’oxygène est une particule très petite que l’on peut représenter par une sphère de rayon 0,15 nanomètre et dont la masse est de l’ordre de 2,7.10-26 kg. Son symbole est O.
Rappel : le préfixe nano signifie 10-9 donc : 1 nanomètre = 1 nm = 10-9 m
Tous les atomes d’oxygène sont identiques entre eux.
Le diazote est composé de molécules qui résultent de l’association de deux atomes d’azote d’où le nom de diazote.
Tous les atomes d’azote sont identiques entre eux.
|
Nom
|
Nom des particules
|
Symbole ou formule
|
Schéma des particules
|
|
Oxygène
|
Atome
|
O
|

|
|
Dioxygène
|
Molécule
|
O2
|

|
|
Nom
|
Nom des particules
|
Symbole ou formule
|
Schéma des particules
|
|
Azote
|
Atome
|
N
|

|
|
Diazote
|
Molécule
|
N2
|

|
Conclusion :
L’air est un gaz composé de molécules de dioxygène et de diazote. Il n’existe pas de molécules d’air.
b) L’air possède-t-il un volume ?
Expériences :
Retourner un bécher au dessus d’un récipient d’eau.

Observation :
L’eau ne rentre pas dans le bécher.
Conclusion :
L’air possède un volume. Comme tous les gaz, il occupe toute la place libre.
c) L'air est-il compressible ?
Expériences :
On fait entrer un certain volume d’air dans une seringue (1) puis on essaie de pousser (2) ou de tirer (3) le piston.

Observations :
2 : L'air enfermé tend à repousser le doigt.
3 : L'air enfermé tend à aspirer le doigt.
Le piston a toujours tendance à revenir dans sa position initiale.
Interprétations :
Dans le cas (2), la pression a augmentée.
Dans le cas (3), la pression a diminuée.
La pression d’un gaz se mesure en Pascal (Pa).
Pour mesurer une pression, on utilise un manomètre.
Remarque : On utilise également d’autres unités pour mesurer la pression, comme le bar ou l’hectopascal (hPa).
Conclusion :
L’air ne possède pas de volume propre. On peut :
- Diminuer son volume, on parle alors de compression.
- Augmenter son volume, on parle alors de d’expansion.
d) L'air a-t-il une masse ?
Expériences :
Pour déterminer la masse d’une certaine quantité d’air, on réalise l’expérience suivante :




Observations :
Lorsque l’on gonfle le ballon, la balance indique que la masse du ballon augmente.
Autre exemple avec une bouteille :
Conclusion :
L’air possède une masse qui vaut 1,3 g pour 1L d’air.
a) Modèle particulaire :
La matière est constituée de particules différentes et très petites (invisibles à l’œil nu). Ces particules sont différentes selon la substance qu’elles forment mais elles ont tout de même des propriétés communes :
- Elles sont indéformables (elles ne peuvent pas se casser)
- Elles gardent toujours la même masse.
- Elles sont séparées par du vide.
- Elles sont plus ou moins agitées.
b) Les états de la matière :
1- Les solides :
Dans un solide les particules sont serrées les unes contre les autres et accrochées ensemble. Elles sont pratiquement immobiles. Un solide a donc une forme propre.
On dit que l’état solide est compact et ordonné.

Dans un liquide les particules sont tassées les unes sur les autres mais elles peuvent glisser les unes contre les autres. Elles ne sont pas attachées les unes aux autres, elles ne sont que faiblement liées.
On dit que l’état liquide est compact mais désordonné.

Dans un gaz les particules sont libres dispersées et se déplacent rapidement et de façon désordonnée. Elles se déplacent dans tout le récipient qui les contient.
On dit que l’état gazeux est dispersé et désordonné.

Lors d’un changement d’état d’un corps (d’une substance), le nombre de particule ne change pas. La masse du corps se conserve. Seul son volume et sa température peuvent changer.
5- Le modèle moléculaire :
Pour pouvoir mieux comprendre les propriétés de l’air on utilise un modèle où l’on représente les molécules :
- Les molécules de diazote par :

- Les molécules de dioxygène sont représentées par :

- Les molécules de dioxyde de carbone et d’eau, trop peu nombreuses ne sont pas représentées.
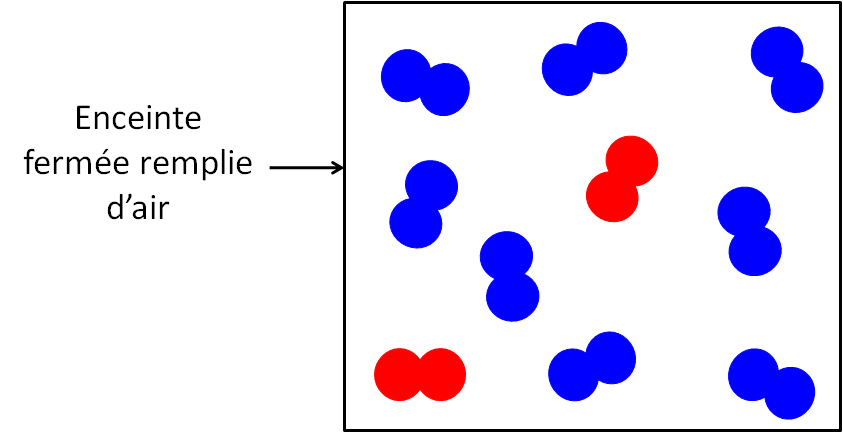
Il doit y avoir 4 fois plus de molécules de diazote que de molécule de dioxygène.
Expériences :
Remplir un tube à essais de dioxygène .Enflammer l'allumette et l'éteindre de façon à ce qu’elle présente un point incandescent et l’introduire dans le tube à essais rempli de dioxygène


.


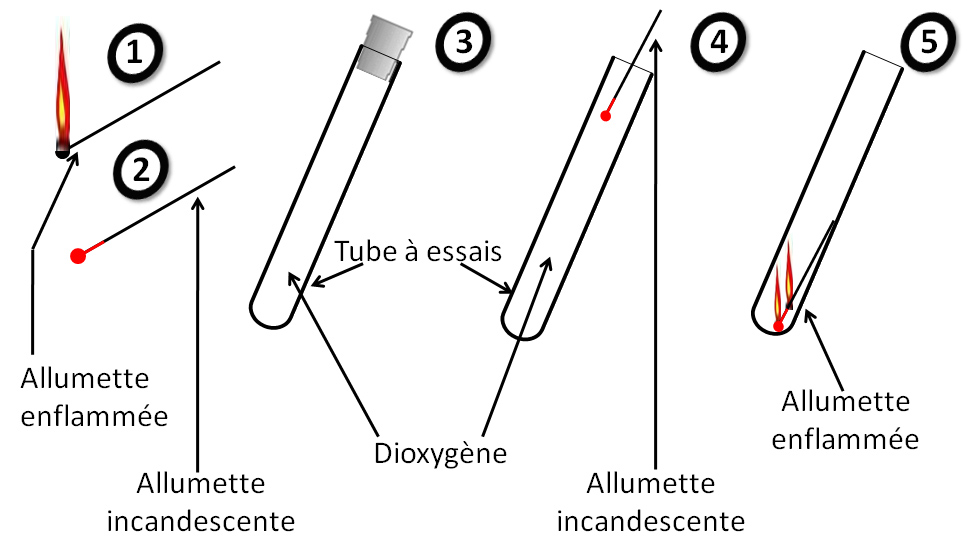
Observations :
L'allumette s’enflamme lorsqu’elle est mise dans le tube à essais rempli de dioxygène.
Conclusion :
Le gaz qui permet à l'allumette de brûler s’appelle le dioxygène.
Pour aller plus loin :
Expliquer pourquoi l'allumette présente un point incandescent dans l’air et se rallume dans le dioxygène.
Dans l’air il y a peu de dioxygène, alors que dans le tube remplie de dioxygène, il n’y a que ce gaz.
a) Méthode :
On peut obtenir du dioxygène en laboratoire par l'action du permanganate de potassium acidifié sur de l'eau oxygénée.
b) Schéma du montage :

c) Vérifier que le gaz obtenu est du dioxygène :
On effectue de nouveau l'expérience précédente avec l'allumette incandescente.
d) Conclusion :
Le gaz obtenu est donc du dioxygène. Il a des propriétés identiques à celui qu'on a récupéré à partir de la bouteille de gaz comprimé.
Pour avoir du dioxygène au laboratoire, on peut donc ajouter du permanganate de potassium sur de l'eau oxygénée.
 - Image © Cebarre -
- Image © Cebarre -  -
- 





































 Cinquième
Cinquième
 Haut
Haut 
